Bittere Pille: Der Corona-Impfstoff und das Problem mit der Produkthaftung

Quelle: CureVac
Zahlreiche Firmen forschen derzeit an einem geeigneten Serum gegen das Corona-Virus – darunter auch das Biotech-Unternehmen Curevac mit seinem Haupteigner Dietmar Hopp. Es könnte ein Blockbuster werden. So bezeichnet man in der Pharmaindustrie Arzneimittel, die einen Umsatz von mehr als einer Mrd. US-Dollar generieren. Doch selbst, wenn sich ein Medikament auf dem Markt durchsetzt, schwebt über den Pharmaherstellern beständig das Damoklesschwert „Produkthaftungsklage“.
Die Erforschung und Entwicklung eines Arzneimittels kosten enorme Beträge. Der Verband Forschender Arzneimittelhersteller (VfA) schätzt die Forschungs- und Entwicklungskosten für ein einziges Arzneimittel auf ca. 1,0 bis 1,6 Mrd. US-Dollar. Die Entwicklung nimmt auch sehr viel Zeit in Anspruch. So dauert es etwa 13 Jahre vom Entdecken einer Substanz über deren Weiterentwicklung, Testung in klinischen Studien bis hin zur Marktreife.
Die Misserfolgsquote ist dabei sehr hoch: nur eins von 5.000 bis 10.000 untersuchten Molekülen schafft es am Ende tatsächlich in den Markt. Im Jahr 2018 gab es in Deutschland 36 Zulassungen für neue Arzneimittel. Das Zulassungsverfahren dauert in der Regel zwölf bis 16 Monate. Die Erforschung eines neuen Wirkstoffes ist somit sehr zeit- und kostenintensiv.
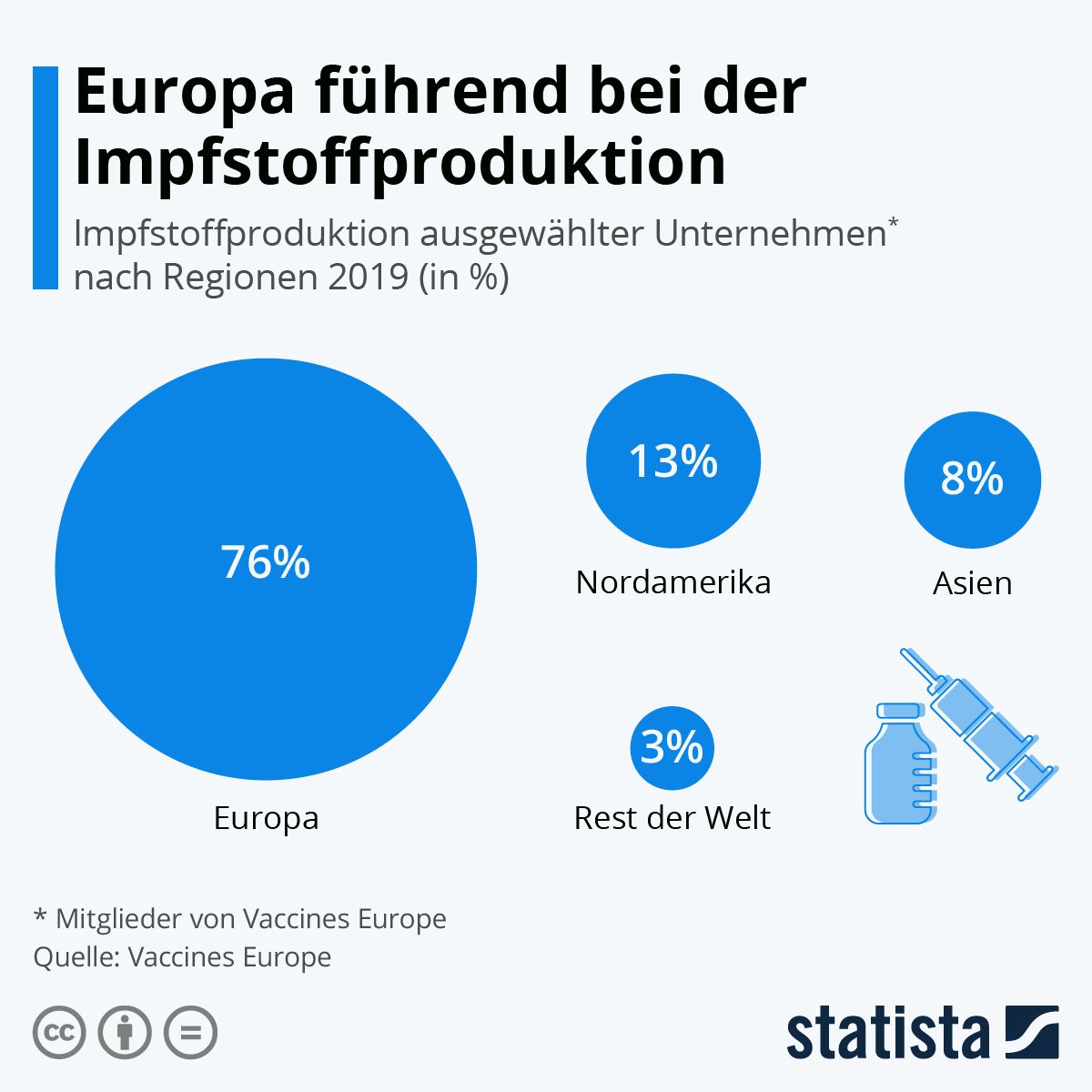
Europa ist bei der Entwicklung von Impfstoffen weltweit führend. So entfallen derzeit 76 Prozent der weltweiten Produktion führender Impfstoff-Unternehmen (organisiert im Verband Vaccines Europe) auf Europa. Es folgen Nordamerika, Asien und mit drei Prozent schließlich der Rest der Welt. Jedes Jahr werden in Europa 1,7 Milliarden Impfstoffe hergestellt. 16 Prozent der Einnahmen investiert die Branche EU-weit in Forschung und Entwicklung.
So verwundert es nicht, dass US-Präsident Donald Trump die Wissenschaftler von Curevac mit hohen finanziellen Zuwendungen in die USA locken wollte. Die Lockrufe waren bekanntlich ohne Erfolg beschieden: „Wenn es uns hoffentlich bald gelingt, einen wirksamen Impfstoff gegen das Corona-Virus zu entwickeln, soll dieser Menschen nicht nur regional, sondern solidarisch auf der ganzen Welt erreichen, schützen und helfen können“, ließ Mäzen Hopp wissen.
Unterstützung erhielt das Biotech-Unternehmen auch aus der Politik: „Wir sind sehr daran interessiert, dass Impf- und Wirkstoffe gegen das Coronavirus auch in Deutschland und in Europa entwickelt werden“, betonte das Bundesgesundheitsministerium. Und der SPD-Gesundheitsexperte Karl Lauterbach ergänzte: „Der exklusive Verkauf eines eventuellen Impfstoffs an die USA muss mit allen Mitteln verhindert werden.“
Die USA nicht mit Arzneimitteln zu beliefern, ist derzeit ab er keine Option für die Hersteller, da im US-Markt der mit Abstand größte Umsatz erzielt wird (485 Milliarden US-Dollar im Jahr 201814) und dieser damit erheblich zur (Re-)Finanzierung der Forschungs- und Entwicklungskosten beiträgt. Wenn der Versicherungsmarkt als Risikoträger ausscheidet, bliebe zu prüfen, ob Zugang zu alternativem Risikokapital gefunden, ob also möglicherweise Interesse bei Risikokapitalgebern geweckt werden kann, die in Niedrigzinszeiten nach lukrativen Investitionsmöglichkeiten Ausschau halten. Das gestaltet sich aber insgesamt schwierig, da unkalkulierbarere „long tail“-Risiken nicht unbedingt im Investitionsfokus von Investoren außerhalb der Versicherungsbranche stehen.
„Die Schadenerfahrungen der Versicherer weisen zwischenzeitlich auch Schäden durch langfristig im Markt befindliche Produkte auf.“
Nicole Junghans, Rechtsanwältin bei Merck KGaA
Kampf gegen die Zeit und die Konkurrenz
Allein im Kampf gegen den Corona-Virus werden derzeit rund 150 potenzielle Impfstoffe entwickelt. Davon werden bereits 23 am Menschen getestet. Allerdings geht es in der ersten Phase der Entwicklung noch nicht um die Wirksamkeit, sondern vielmehr um die Sicherheit des möglichen Impfstoffes. Um die hohen Forschungs- und Entwicklungskosten zu decken, befindet sich das Unternehmen in einem Wettlauf gegen die Zeit, denn noch während der Forschungs- und Entwicklungsphase wird Patentschutz für das Molekül beantragt.
Der Zeitraum, in dem der Hersteller durch Patentschutz und ein sogenanntes Ergänzendes Schutzzertifikat schließlich Marktexklusivität genießt, beträgt in Europa typischerweise daher nur noch rund zwölf Jahre. Für die exklusive Vermarktung und damit einhergehend auch für die Refinanzierung der Forschungs- und Entwicklungskosten bleiben nur wenige Jahre. Denn mit dem Ablauf des Patentschutzes drängen Generika bzw. Biosimilars in den Markt.
Dies kann zu einem dramatischen Preisverfall bzw. Umsatzeinbruch des Originalproduktes führen, wie folgendes Beispiel zeigt: Das mit Abstand wertvollste Arzneimittel der Welt, Humira, brachte es im Jahr 2018 weltweit auf rund 22 Mrd. US-Dollar Umsatz. Im Oktober 2018 lief das Basispatent in Europa aus. Im August des Folgejahres soll der Marktanteil des Originalproduktes gerade noch rund 53 Prozent betragen haben.
Hat es ein Mittel schließlich in die Vermarktungsphase geschafft, steht das Unternehmen vor weiteren Herausforderungen. Zum einen soll das Produkt nun möglichst schnell zur Refinanzierung der Entwicklungskosten beitragen. Jedoch decken nur etwa ein Drittel der Medikamente jemals ihre durchschnittlichen Forschungs- und Entwicklungskosten. Entsprechend hohe Arzneimittelpreise sind erforderlich.
In der Presse werden, die zum Teil sehr hohen Preise für Arzneimittel vielfach kritisiert. Es ist jedoch keinesfalls, sodass Pharmaunternehmen völlig frei in der Preisgestaltung sind. Vielmehr ist die Preisfindung in vielen Ländern reguliert. Zum anderen können die Gesundheitsbehörden eine Marktzulassung zurückziehen, wenn sich die Bewertung der Risiko-Nutzen-Analyse des Produktes z.B. aufgrund des Auftretens schwerwiegender Nebenwirkungen ändert.
Das Problem mit der Produkthaftung
Ein solcher Vermarktungsstopp trifft das Pharmaunternehmen schwer. Schließlich schwebt über den Pharmaherstellern beständig das Damoklesschwert „Produkthaftungsklagen“: Mit der Vermarktung von Human-Arzneimitteln ist per se ein hohes Produkthaftungsrisiko wegen möglicher, bisweilen schwerer Personenschäden verbunden. Dabei haftet neuen Produkten grundsätzlich ein höheres Risiko an, als schon länger im Markt befindlichen Medikamenten.
Auch wenn grundsätzlich gilt, dass längerfristig im Markt befindliche Produkte ein geringeres Produkthaftungsrisiko aufweisen als Neueinführungen, können bei Ersteren aufgrund des langjährigen Vertriebes große Patientenpopulationen erreicht werden, die das Produkt bei entsprechenden Anzeichen für Sicherheitsprobleme für die US-Anwaltsindustrie ebenfalls interessant machen können. Die Schadenerfahrungen der Versicherer weisen zwischenzeitlich auch Schäden durch langfristig im Markt befindliche Produkte auf.
An dieser Stelle sollen nur einzelne Schadenfälle erwähnt werden, die die beschriebene Situation exemplarisch verdeutlichen: Laut Medienberichten musste Wyeth (vormals American Home Products) vor einigen Jahren für Vergleiche mit 110.000 Klägern rund 22 Mrd. US-Dollar im Zusammenhang mit dem Life-Style-Medikament und Schlankheitsmittel Fen-Phen zahlen.
Für das Schmerzmittel Vioxx hatte das US-amerikanische Unternehmen Merck & Co.laut Zeitungsberichten vor einigen Jahren einen Vergleich mit ca. 60.000 Klägern über 4,85 Mrd. US-Dollar geschlossen. Merck & Co. teilte seinerzeit nicht überraschend mit, dass der Versicherungsschutz nicht ausreichend sei, um die entstandenen Kosten zu decken. In der jüngeren Vergangenheit wurde in den Medien auch über US-Vergleiche zweier deutscher Unternehmen im Bereich von 500 Mio. Euro berichtet.
Nur zwei bis drei Player für die Pharmaprodukthaftpflichtversicherung
Daher kommt der Pharmaprodukthaftpflichtversicherung ein sehr hoher Stellenwert im Rahmen des Risikomanagements zu. Der Risikotransfer in den Versicherungsmarkt soll das Unternehmen zumindest zu einem gewissen Teil vor den schweren finanziellen Folgen eines großen Produkthaftungsschadens schützen.
Die Bedeutung der Produkthaftpflichtversicherung für ein forschendes Pharmaunternehmen ist somit nicht zu unterschätzen. Leider befriedigt der Versicherungsmarkt die Bedürfnisse der Unternehmen nicht. Dies liegt zum einen daran, dass nur eine überschaubare Anzahl an Versicherern im deutschen Markt bereit ist, Pharmarisiken zu zeichnen.
Einige Versicherer engagieren sich zwar als Rückversicherer im sog. Pharmapool der AMG-Versicherung, stehen den großen Pharmaunternehmen aber nicht als Erstversicherer für die internationale Betriebs- und Produkthaftpflichtversicherung zur Verfügung. Weitere Fusionen zwischen Versicherungsunternehmen könnten zu einer zusätzlichen Kapazitätsverknappung führen und die Situation weiter verschärfen.
Der Gang zu Bermuda-Versicherern oder auch nach Asien sollte indes aufgrund der daraus resultierenden Einschränkungen und Unwägbarkeiten, insbesondere in Hinblick auf ein einheitliches (following form) Wording und die geringere Rechtssicherheit, gut überlegt werden.
Es besteht aufgrund der wenigen Agierenden kein Wettbewerb in diesem Marktsegment. Für die Führung eines großen internationalen Pharmahaftpflichtprogrammes stehen im Wesentlichen nur zwei bis drei Versicherer zur Verfügung. Folglich sind die Handlungsoptionen und damit auch die Verhandlungsposition der Pharmaunternehmen erheblich eingeschränkt.
Gerade in der aktuellen Situation, in der die Menschheit gegen ein aggressives, tödliches Virus ankämpft, dürfte die Bedeutung und Wichtigkeit der Arzneimittelforschung einer breiten Öffentlichkeit bewusst geworden sein. Dies gilt auch für die Sicherstellung der Arzneimittelversorgung. Doch Kostenaspekte haben in den vergangenen Jahren dazu geführt, dass viele Generika beispielsweise in Indien gefertigt werden.
Lieferengpässe bei bestimmten Arzneimitteln gibt es seit Jahren, die Abhängigkeit in diesem Zusammenhang beispielsweise von Indien und China scheint aber erst in diesen besonderen Zeiten tiefer in das öffentliche Bewusstsein vorgedrungen zu sein. Es bleibt zu hoffen, dass hieraus entsprechende Lehren gezogen werden.
Geht es nach dem Kriterium Schnelligkeit, hat der russische Staatspräsident Wladimir Putin bei der Erstzulassung eines möglichen Corona-Impfstoffes bereits die Nase vorn. Dabei hatte er beteuert, dass der Impfstoff sicher sei und bereits einer seiner Töchter verabreicht wurde. Kritiker befürchten der Präsident stelle nationales Ansehen vor die Sicherheit der Bevölkerung und ignoriere wissenschaftliche Normen, weil das Mittel aus dem Moskauer Gamaleya Institut erst zwei Monate an Menschen getestet wurde und sich nicht einmal in Phase III der Tests befindet.
„Dieses Rennen können wir nicht gewinnen. Aber wir wollen das Rennen um den besten Impfstoff gewinnen, und da haben wir gute Chancen.“
Dietmar Hopp, SAP-Gründer und Mehrheitseigentümer des Tübinger Biotechunternehmens Curevac
Hopp selbst rechnet jedenfalls gegenüber dem Handelsblatt noch in diesem Jahr mit rund 100 Mio. Impfdosen. Dabei sei es „auch nicht völlig ausgeschlossen werden kann, dass der Impfstoff noch in diesem Jahr auf Basis von Interimsdaten zugelassen wird, etwa für bestimmte, besonders gefährdete Berufsgruppen oder Regionen. Das müssen die Behörden entscheiden, wenn die Daten vorliegen.“
Dabei geht es für Haupteigner vielmehr um Qualität und nicht um Schnelligkeit: „Wir werden sicher nicht die Ersten sein. Dieses Rennen können wir nicht gewinnen. Aber wir wollen das Rennen um den besten Impfstoff gewinnen, und da haben wir gute Chancen.“
Autoren: Nicole Junghans, Rechtsanwältin bei Merck KGaA und Tobias Daniel (VW-Redaktion)
Mehr zum Thema lesen Sie in der aktuellen September-Ausgabe der Versicherungswirtschaft.

